
La vida es una colección de reacciones químicas, en sucesión, en paralelo, en serie o a la vez, en fase o desfase… Que esas reacciones se produzcan en la velocidad y el momento adecuados son la causa de salud o enfermedad, de alegría o tristeza. De cómo se realicen esas reacciones se ocupan unas biomoléculas fascinantes: LAS ENZIMAS.
Las enzimas son proteínas que catalizan reacciones químicas, ósea hacen factible que se produzca una reacción que, siendo energéticamente posible, transcurre a una velocidad muy baja. Pero las enzimas son extremadamente selectivas con sus sustratos y, su velocidad de transformación en productos, crece solo con algunas reacciones y, por tanto, el conjunto de enzimas presentes en una célula determina el tipo de metabolismo que puede llevar a cabo dicha célula.
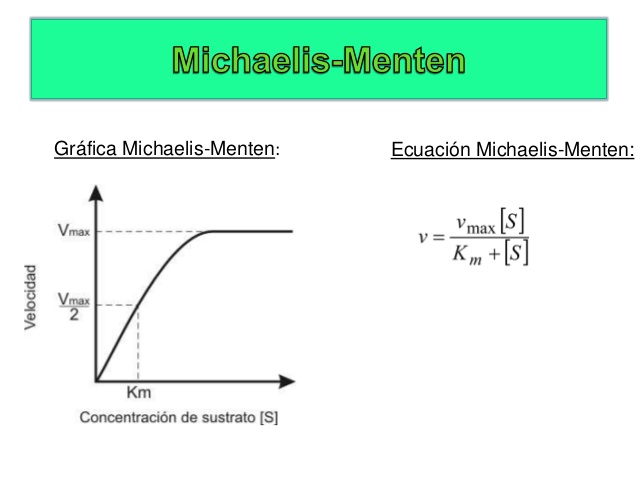
Una joven investigadora fue la responsable de que hoy se pueda cuantificar y predecir este proceso: Maude Leonora Menten. Ella fue la científica canadiense que en 1912 en la Universidad de Berlín, trabajando con Leonor Michaelis, diseñó el modelo matemático que permite definir a qué velocidad se dará una reacción en presencia de la enzima adecuada. En definitiva, puso los pilares de lo que se denomina cinética enzimática. Juntos propusieron un modelo simple para explicar la mayoría de las reacciones catalizadas por enzimas. En este modelo la enzima se combina, reversiblemente, con su sustrato para formar un complejo enzima-sustrato que cuando se rompe formará el producto de la reacción y regenerará a la enzima.
Una consecuencia de su trabajo es que permitió definir la constante de Michaelis-Menten (Km) que es característica de cada enzima y particular para su sustrato. Este parámetro Km no varía con la concentración de enzima, pero informa sobre su “eficacia”. Así una Km pequeña refleja una alta afinidad de la enzima por su sustrato porque, a una baja concentración del mismo, la enzima ha conseguido que la reacción alcance la mitad de la velocidad máxima de generación de producto. Mientras que una Km alta implica una baja afinidad de la enzima por su sustrato y, sólo a una concentración elevada del mismo, la enzima conseguirá desarrollar la mitad de su velocidad máxima de reacción.
Las enzimas están presentes en todos los procesos metabólicos…Y enzimas son las “monoamino oxidasas” (MAO).
Las MAO (aunque fueron descubiertas por Mary Hare en el hígado) están presentes en el sistema nervioso, en neuronas y astroglía catalizando la reacción que utiliza el oxígeno para eliminar un grupo amino de una molécula, resultando el correspondiente aldehído y amonio. En concreto, las MAO catalizan la degradación de neurotransmisores como la serotonina.
En tanto que enzimas, de la velocidad que las MAO permitan para que se dé la reacción, depende el tiempo que los neurotransmisores tienen para circular por el cerebro. Debido a este papel clave en la inactivación de la serotonina, entre otros, las disfunciones de la MAO (por exceso o defecto de actividad) son causantes de algunos de los trastornos neurológicos más frecuentes, como la depresión. Por ello, las investigaciones farmacológicas se centraron entonces en controlar la cinética de este grupo de enzimas diseñando inhibidores de la misma: los conocidos I-MAO (uno de los más importantes tipos de medicamentos prescritos para el tratamiento de la enfermedad)
De modo que conocer cómo controlar la velocidad de la reacción química resultó ser vital para la salud mental…Y así la señora Mentén ayudó a controlar la depresión.